Digite uma palavra ou frase em qualquer idioma 👆
Idioma:
Tradução e análise de palavras por inteligência artificial ChatGPT
Nesta página você pode obter uma análise detalhada de uma palavra ou frase, produzida usando a melhor tecnologia de inteligência artificial até o momento:
- como a palavra é usada
- frequência de uso
- é usado com mais frequência na fala oral ou escrita
- opções de tradução de palavras
- exemplos de uso (várias frases com tradução)
- etimologia
O que (quem) é MN - definição
ХИМИЧЕСКИЙ ЭЛЕМЕНТ С ПОРЯДКОВЫМ НОМЕРОМ 25
Mn; Manganum; Марганец, химический элемент
Марганец
2) Джезды
марганец
Марганец
I
Ма́рганец (лат. Manganum)
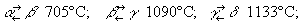
Mn, химический элемент VII группы периодической системы Менделеева; атомный номер 25, атомная масса 54,9380; тяжёлый серебристо-белый металл. В природе элемент представлен одним стабильным изотопом 55Mn.
Историческая справка. Минералы М. известны издавна. Древнеримский натуралист Плиний упоминает о чёрном камне, который использовали для обесцвечивания жидкой стеклянной массы; речь шла о минерале пиролюзите MnO2. В Грузии пиролюзит с древнейших времён служил присадочным материалом при получении железа. Долгое время пиролюзит называли чёрной магнезией и считали разновидностью магнитного железняка (Магнетита). В 1774 К. Шееле показал, что это соединение неизвестного металла, а другой шведский учёный Ю. Ган, сильно нагревая смесь пиролюзита с углём, получил М., загрязнённый углеродом. Название М. традиционно производят от немецкого Manganerz - марганцевая руда.
Распространение в природе. Среднее содержание М. в земной коре 0,1 \%, в большинстве изверженных пород 0,06-0,2 \% по массе, где он находится в рассеянном состоянии в форме Mn2+ (аналог Fe2+). На земной поверхности Mn2+ легко окисляется, здесь известны также минералы Mn3+ и Mn4+ (см. Марганцевые руды). В биосфере М. энергично мигрирует в восстановительных условиях и малоподвижен в окислительной среде. Наиболее подвижен М. в кислых водах тундры и лесных ландшафтов, где он находится в форме Mn2+. Содержание М. здесь часто повышено и культурные растения местами страдают от избытка М.; в почвах, озёрах, болотах образуются железо-марганцевые конкреции, озёрные и болотные руды. В сухих степях и пустынях в условиях щелочной окислительной среды М. малоподвижен, организмы бедны М., культурные растения часто нуждаются в марганцевых микроудобрениях. Речные воды бедны М. (10-6-10-5 г/л), однако суммарный вынос этого элемента реками огромен, причём основная его масса осаждается в прибрежной зоне. Ещё меньше М. в воде озёр, морей и океанов; во многих местах океанического дна распространены железо-марганцевые конкреции, образовавшиеся в прошлые геологические периоды.
Физические и химические свойства. Плотность М. 7,2-7,4 г/см3, tпл 1245 °С; tкип 2150 °C. М. имеет 4 полиморфные модификации: α-Mn (кубическая объёмноцентрированная решётка с 58 атомами в элементарной ячейке), β-Mn (кубическая объёмноцентрированная с 20 атомами в ячейке), γ-Mn (тетрагональная с 4 атомами в ячейке) и δ-Mn (кубическая объёмноцентрированная). Температура превращений:
α-модификация хрупка; γ (и отчасти β) пластична, что имеет важное значение при создании сплавов.
Атомный радиус М. 1,30 Å. Ионные радиусы (в Å): Mn2+ 0,91, Mn4+ 0,52, Mn7+ 0,46. Прочие физические свойства α-Mn: удельная теплоёмкость(при 25 °С) 0,478 кдж/(кг·К) [то есть 0,114 кал/ (г·°С)]; температурный коэффициент линейного расширения (при 20 °С) 22,3․10-6 град -1 теплопроводность (при 25 °С) 66,57 вт/(м․К) [то есть 0,159 кал/(см·сек °С)]; удельное объёмное электрическое сопротивление 1,5-2,6 мком·м (то есть 150-260 мком·см); температурный коэффициент электрического сопротивления (2-3)․10-4 град -1 М. парамагнитен.
Химически М. достаточно активен, при нагревании энергично взаимодействует с неметаллами - кислородом (образуется смесь окислов М. разной валентности), азотом (Mn4N, Mn2N1, Mn3N2), серой (MnS, MnS2), углеродом (Mn3C, Mn23C6, Mn7C3, Mn5C6), фосфором (Mn2P, MnP) и др. При комнатной температуре М. на воздухе не изменяется; очень медленно реагирует с водой. В кислотах (соляной, разбавленной серной) легко растворяется, образуя соли двухвалентного М. При нагревании в вакууме М. легко испаряется даже из сплавов.
М. образует сплавы со многими химическими элементами; большинство металлов растворяется в отдельных его модификациях и стабилизирует их. Так, Cu, Fe, Со, Ni и другие стабилизируют γ-модификацию. Al, Ag и другие расширяют области β- и σ-Mn в двойных сплавах. Это имеет важное значение для получения сплавов на основе М., поддающихся пластической деформации (ковке, прокатке, штамповке).
В соединениях М. обычно проявляет валентность от 2 до 7 (наиболее устойчивы степени окисления +2, +4 и +7). С увеличением степени окисления возрастают окислительные и кислотные свойства соединений М.
Соединения Mn(+2) - восстановители. Окись MnO - порошок серо-зелёного цвета; обладает основными свойствами, нерастворима в воде и щелочах, хорошо растворима в кислотах. Гидроокись Mn(OH)2 - белое вещество, нерастворимое в воде. Соединения Mn(+4) могут выступать и как окислители (а) и как восстановители (б):
MnO2+4HCl = MnCl2 + Cl2 + 2H2O (a)
(по этой реакции в лабораториях получают Хлор)
MnO2 + KClO3 + 6KOH = ЗК2МnO4 + KCl + ЗН2О (б)
(реакция идёт при сплавлении).
Двуокись MnO2 - черно-бурого цвета, соответствующая гидроокись Mn(OH)4 - темно-бурого цвета. Оба соединения в воде нерастворимы, оба амфотерны с небольшим преобладанием кислотной функции. Соли типа K4MnO4 называются манганитами.
Из соединений Mn(+6) наиболее характерны Марганцовистая кислота и её соли манганаты. Весьма важны соединения Mn(+7) - марганцовая кислота, марганцовый ангидрид и Перманганаты.
Получение. Наиболее чистый М. получают в промышленности по способу советского электрохимика Р. И. Агладзе (1939) электролизом водных растворов MnSO4 с добавкой (NH4)2SO4 при pH = 8,0-8,5. Процесс ведут с анодами из свинца и катодами из титанового сплава АТ-3 или нержавеющей стали. Чешуйки М. снимают с катодов и, если необходимо, переплавляют. Галогенным процессом, например хлорированием руды Mn, и восстановлением галогенидов получают М. с суммой примесей около 0,1 \%. Менее чистый М. получают алюминотермией (См. Алюминотермия) по реакции:
3Мn3O4 + 8Al = 9Mn + 4Al2O3,
а также электротермией (См. Электротермия).
Применение. Основной потребитель М. - чёрная металлургия, расходующая в среднем около 8-9 кг М. на 1 т выплавляемой стали. Для введения М. в сталь применяют чаще всего его сплавы с железом - ферромарганец (70-80 \% М., 0,5-7,0 \% углерода, остальное железо и примеси). Выплавляют его в доменных и электрических печах (см. Ферросплавы). Высокоуглеродистый ферромарганец служит для раскисления и десульфурации стали; средне- и малоуглеродистый - для легирования стали. Малолегированная конструкционная и рельсовая сталь содержит 0,9-1,6 \% Mn; высоколегированная, очень износоустойчивая сталь с 15 \% Mn и 1,25 \% C (изобретена английским металлургом Р. Гейрилдом в 1883) была одной из первых легированных сталей. В СССР производится безникелевая нержавеющая сталь, содержащая 14 \% Cr и 15 \% Mn.
М. используется также в сплавах на нежелезной основе (см., например, Манганин). Сплавы меди с М. применяют для изготовления турбинных лопаток; марганцовые бронзы - при производстве пропеллеров и других деталей, где необходимо сочетание прочности и коррозионной устойчивости. Почти все промышленные Алюминиевые сплавы и Магниевые сплавы содержат М. Разработаны деформируемые сплавы на основе М., легированные медью, никелем и другими элементами. Гальваническое покрытие М. применяется для защиты металлических изделий от коррозии.
Соединения М. применяют и при изготовлении гальванических элементов; в производстве стекла и в керамической промышленности; в красильной и полиграфической промышленности, в сельском хозяйстве (см. Микроудобрения) и т. д.
Ф. Н. Тавадзе.
Марганец в организме. М. широко распространён в природе, являясь постоянной составной частью растительных и животных организмов. Содержание М. в растениях составляет десятитысячные - сотые, а в животных - стотысячные - тысячные доли процента. Беспозвоночные животные богаче М., чем позвоночные. Среди растений значительное количество М. накапливают некоторые ржавчинные грибы, водяной орех, ряска, бактерии родов Leptothrix, Crenothrix и некоторые диатомовые водоросли (Cocconeis) (до нескольких процентов в золе), среди животных - рыжие муравьи, некоторые моллюски и ракообразные (до сотых долей процента). М. - активатор ряда ферментов, участвует в процессах дыхания, фотосинтезе, биосинтезе нуклеиновых кислот и др., усиливает действие инсулина и других гормонов, влияет на кроветворение и Минеральный обмен. Недостаток М. у растений вызывает Некрозы, хлороз яблони и цитрусовых, пятнистость злаков, ожоги у картофеля, ячменя и т. п. М. обнаружен во всех органах и тканях человека (наиболее богаты им печень, скелет и щитовидная железа). Суточная потребность животных и человека в М. - несколько мг (ежедневно с пищей человек получает 3-8 мг М.). Потребность в М. повышается при физической нагрузке, при недостатке солнечного света; дети нуждаются в большем количестве М., чем взрослые. Показано, что недостаток М. в пище животных отрицательно влияет на их рост и развитие, вызывает анемию, так называемую лактационную тетанию, нарушение минерального обмена костной ткани. Для предотвращения указанных заболеваний в корм вводят соли М.
Г. Я. Жизневская.
В медицине некоторые соли М. (например, KMnO4) применяют как дезинфицирующие средства (см. Перманганат калия). Соединения М., применяемые во многих отраслях промышленности, могут оказывать токсическое действие на организм. Поступая в организм главным образом через дыхательные пути, М. накапливается в паренхиматозных органах (печень, селезёнка), костях и мышцах и выводится медленно, в течение многих лет. Предельно допустимая концентрация соединений М. в воздухе - 0,3 мг/м3. При выраженных отравлениях наблюдается поражение нервной системы с характерным синдромом марганцевого Паркинсонизма.
Лечение: витаминотерапия, холинолитические средства и др. Профилактика: соблюдение правил гигиены труда.
Лит.: Салли А. Х., Марганец, перевод с английского, М., 1959; Производство ферросплавов, 2 изд., М., 1957; Пирсон А., Марганец и его роль в фотосинтезе, в сборнике: Микроэлементы, перевод с английского, М., 1962.
II
Ма́рганец
город в Днепропетровской области УССР. Расположен на берегу Каховского водохранилища. Железнодорожная станция на линии Кривой Рог - Запорожье. 48,9 тысячи жителей (1973).
Основан в 1883-86 как рабочий посёлок в связи с началом разработки марганцевого месторождения; преобразован в город в 1938. К 1940 в городе было 20 шахт и 4 обогатительных фабрики. В годы Великой Отечественной войны 1941-45 М. с 17 августа 1941 до 5 февраля 1944 был оккупирован немецко-фашистскими войсками, нанёсшими городу большой урон. В первую послевоенную пятилетку город и его промышленные предприятия были полностью восстановлены; в последующие десятилетия получили развитие экономика, наука и культура. Современный М. - крупный центр Никопольского марганцеворудного бассейна. Имеется горно-обогатительный комбинат по добыче и переработке марганцевой руды, который является поставщиком марганцевого концентрата для металлургических предприятий страны и экспорта. Заводы: рудоремонтный, строительных материалов; фабрики: кондитерская, швейная, мебельная, лентоткацкая. Предприятия пищевой промышленности. Лесомелиоративная станция. Вечернее отделение Криворожского горнорудного института, горный техникум. Историко-краеведческий музей.
Wikipédia
Марганец

Ма́рганец (химический символ — Mn, от лат. Manganum) — химический элемент 7-й группы (по устаревшей классификации — побочной подгруппы седьмой группы, VIIB), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 25.
Простое вещество марганец — это твёрдый, но одновременно с этим, хрупкий переходный металл серебристо-белого цвета. Относится к цветным металлам.
Exemplos do corpo de texto para MN
1. Оба акционера MN считают, что имеют право выкупить допэмиссию акций MN.
2. MN приходилось покупать нефть, которая транспортировалась морем.
3. Проблемы MN были вызваны двумя основными причинами.
4. Поставки нефти с терминала обходятся MN дороже на несколько долларов за тонну, сетует представитель MN Гедрюс Карсокас.
5. Литве принадлежит 40,66% акций MN, и она рассматривает возможность продажи части своего пакета вместе с акциями MN, принадлежащими ЮКОСу.


![[[Диаграмма Пурбе]] для марганца [[Диаграмма Пурбе]] для марганца](https://commons.wikimedia.org/wiki/Special:FilePath/Poutbaix-mn.png?width=200)
